АКІ́НЧЫЦ (Фабіян Іванавіч) (20.1.1886,
Я.Вапа.
АКІ́НЧЫЦ (Фабіян Іванавіч) (20.1.1886,
Я.Вапа.
Акінчыц Іван Іванавіч
АКІНШЭ́ВІЧ (Леў Аляксандравіч) (6.2.1898, С.-Пецярбург — 1980),
Ю.Р.Васілеўскі.
АКІСЛЕ́ННЕ
працэс злучэння якога-
АКІСЛЕ́ННЕ-АДНАЎЛЕ́ННЕ,
хімічныя рэакцыі, пры якіх адбываецца пераход электронаў ад атамаў, малекул ці іонаў аднаго злучэння да атамаў, малекул і іонаў другога. Паводле электроннай тэорыі акісленне вызначаецца як страта (
АКІСЛЕ́ННЕ БІЯЛАГІ́ЧНАЕ,
біяхімічны працэс, сукупнасць акісляльна-аднаўляльных рэакцый. Адбываецца ва ўсіх жывых клетках (пераважна ў мітахондрыях), складае аснову тканкавага дыхання і браджэння.
Вывучэнне працэсаў акіслення ў арганізме пачалося ў 18
На Беларусі розныя аспекты акіслення біялагічнага вывучаюць у ін-тах біяарганічнай хіміі, фотабіялогіі, фізіялогіі, біяхіміі (Гродна)
Літ.:
Кривобокова С.С. Биологическое окисление: Ист. очерк М., 1971;
Ленинджер А. Основы биохимии:
Строев Е.А. Биологическая химия. М., 1986;
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. 2 изд. М., 1990.
М.М.Філімонаў.
АКІСЛЕ́ННЕ МЕТА́ЛАЎ,
рэакцыя злучэння металаў з кіслародам з утварэннем аксідаў; рэакцыя, у якой атамы металу страчваюць электроны і ўтвараюць розныя злучэнні (сульфіды, хларыды і
АКІСЛЕ́ННЯ СТУПЕ́НЬ,
умоўны паказчык, які характарызуе зарад атама ў Na + I, Cl – I Na + 1, Cl – 1. У злучэннях з кавалентнай сувяззю за акіслення ступень прымаецца зарад, які атрымаў бы атам, калі б усе пары электронаў гэтай сувязі былі цалкам зрушаны ў бок больш электраадмоўных атамаў. Электронныя пары, абагульненыя аднолькавымі атамамі, дзеляцца папалам. Акіслення ступень выкарыстоўваецца пры складанні ўраўненняў рэакцый акіслення-аднаўлення, пры класіфікацыі неарган. злучэнняў, асабліва каардынацыйных (
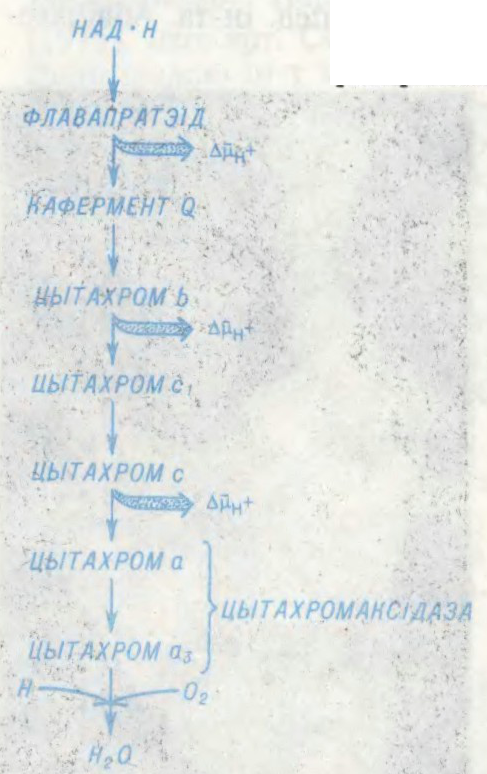
АКІСЛЯ́ЛЬНАЕ ФАСФАРЫЛІ́РАВАННЕ,
біясінтэз малекул адэназінтрыфосфарнай к-ты (АТФ) з адэназіндыфосфарнай (АДФ) і фосфарнай
М.М.Філімонаў.
АКІСЛЯ́ЛЬНА-АДНАЎЛЯ́ЛЬНЫ ПАТЭНЦЫЯ́Л,
значэнне свабоднай энергіі дынамічна ўраўнаважанай акісляльна-аднаўляльнай сістэмы ў электрахім. Працэсе; раўнаважны электродны патэнцыял. Характарызуе пэўнае электралітычнае асяроддзе.