Карма-
Беларуская Савецкая Энцыклапедыя (1969—76, паказальнікі; правапіс да 2008 г., часткова)
Карма-
Беларуская Савецкая Энцыклапедыя (1969—76, паказальнікі; правапіс да 2008 г., часткова)
БАРЫСЕ́ВІЧ (Аляксей Іванавіч) (25.6.1880,
вынаходнік-самавук. Герой Працы (1934). Працаваў у
А.І.Болсун.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГА́ЛІЙ (
Ga, хімічны элемент III групы перыядычнай сістэмы,
Светла-шэры легкаплаўкі (tпл 29,76 °C) метал з
Выкарыстоўваюць у вытв-сці паўправадніковых матэрыялаў, для «халоднай
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
АМО́НІЮ ЗЛУЧЭ́ННІ,
хімічныя злучэнні з зараджаным атамам азоту (амонію катыёнам), які кавалентна звязаны з вадародам ці
Літ.:
Общая органическая химия. Т. 3. М., 1982.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
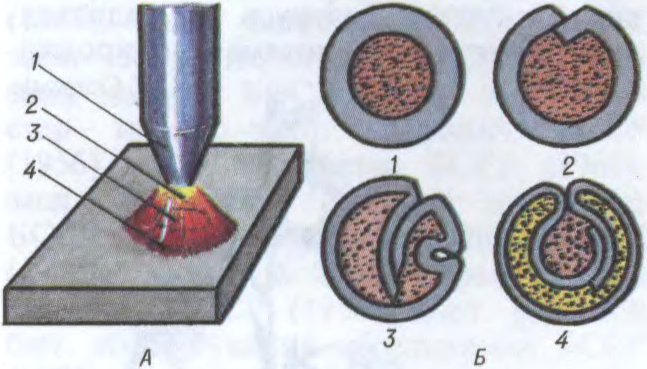
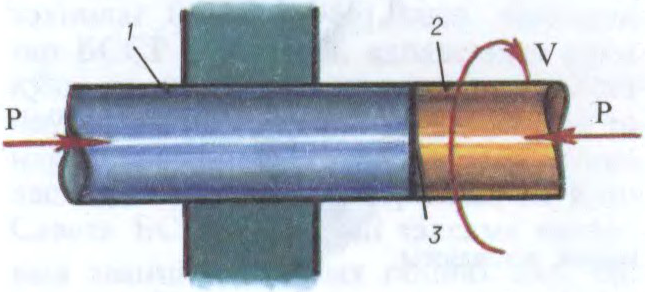
ЗВА́РКА,
нераздымнае злучэнне дэталей машын, канструкцый і збудаванняў пры іх награванні або пластычным дэфармаванні, у выніку якіх у месцы злучэння ўстанаўліваюцца трывалыя міжатамныя сувязі. Вызначаецца прадукцыйнасцю, універсальнасцю і эканамічнасцю. Пашырана ў прам. вытв-сці і буд-ве (
Адрозніваюць З. плаўленнем і
З.; ад спосабу аховы зварнога шва ад шкоднага ўздзеяння паветра — З. ў ахоўных газах, у вакууме, пад флюсам, з аховай шлакам; ад тыпу электродаў — З. плаўкімі і няплаўкімі (вугальнымі, вальфрамавымі і
Літ.:
Сварка в
Руге Ю. Техника сварки: Справ.
Гурд Л.М. Основы технологии сварки:
Верховенко Л.В., Тукин А.К. Справочник сварщика.
Гуревич С.М. Справочник по сварке цветных металлов. 2 изд. Киев, 1990;
Сварка и свариваемые материалы: Справ.
У.М.Сацута.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)