МАЛІБДА́ТЫ,
солі малібдэнавых кіслот.
Монамалібдаты, ці нармальныя
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
МАЛІБДА́ТЫ,
солі малібдэнавых кіслот.
Монамалібдаты, ці нармальныя
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ЗАЛАЦІ́СТЫЯ ВО́ДАРАСЦІ (Chrysophyta),
аддзел ніжэйшых раслін; прадстаўнікі фітапланктону. Каля 120 родаў. Больш за 400 відаў. Пашыраны ўсюды, пераважна ў прэсных водах; характэрны для кіслых вод сфагнавых балот; жывуць у морах і салёных азёрах, зрэдку ў глебе. Планктонныя, эпіфітныя, бентасныя арганізмы. З’яўляюцца важным звяном трафічнага цыкла вадаёмаў (першасныя прадуцэнты
Аднаклетачныя, каланіяльныя, радзей шматклетачныя арганізмы рознай формы. Рухомыя, плаваюць свабодна або прымацоўваюцца. Колер залаціста-жоўты, часам буравата-зялёны, радзей зеленавата-жоўты з-за хларафілу, жоўтых пігментаў (караціноідаў, фукаксанціну). Кветкі рознай формы, аднаядравыя, без цвёрдай абалонкі, некат. ў крэменязёмным лускавінкавым панцыры з іголкамі, шыпамі або ў «хатцы» (своеасаблівы панцыр). Маюць 1—2 (3—4) жгуцікі, скарачальныя вакуолі і вочка. Хларапластаў 1—2, пасценныя, карытападобныя. Запасныя
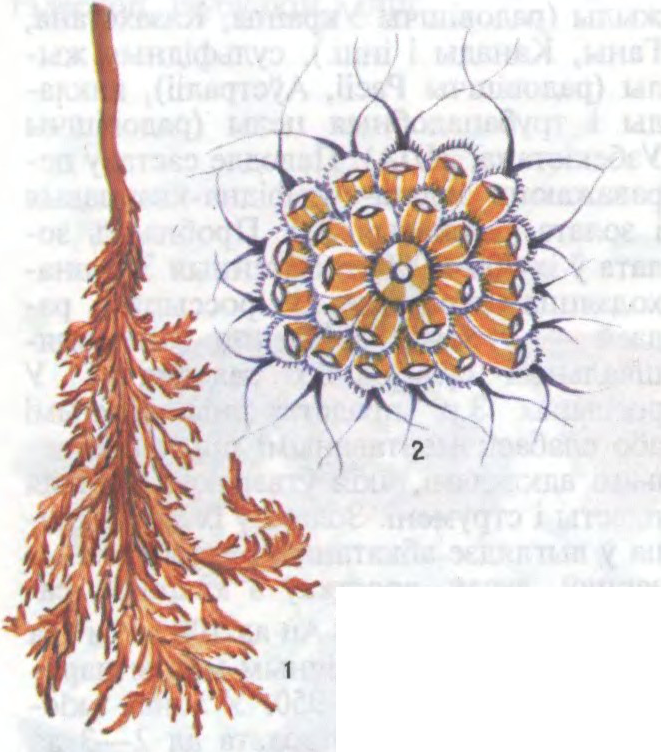
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
«ДЗІЦЯ́ЧАЯ ЭНЦЫКЛАПЕ́ДЫЯ»,
шматтомнае універсальнае энцыклапедычнае выданне для дзяцей. Выдадзена ў 1958—77 у Маскве выд-вам «Вялікая Савецкая Энцыклапедыя». Выйшлі 3 выданні: 1-е ў 10 т. (1958—62), 2-е і 3-е ў 12 т. (1964—69 і 1971—77). Прынцып пабудовы ўсіх выданняў «Дз.э.» — тэматычна-алфавітны. Кожны том мае ўласную назву і складаецца з некалькіх раздзелаў (
Сярод
В.К.Шчэрбін.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
АКІСЛЕ́ННЕ БІЯЛАГІ́ЧНАЕ,
біяхімічны працэс, сукупнасць акісляльна-аднаўляльных рэакцый. Адбываецца ва ўсіх жывых клетках (пераважна ў мітахондрыях), складае аснову тканкавага дыхання і браджэння.
Вывучэнне працэсаў акіслення ў арганізме пачалося ў 18
На Беларусі розныя аспекты акіслення біялагічнага вывучаюць у ін-тах біяарганічнай хіміі, фотабіялогіі, фізіялогіі, біяхіміі (Гродна)
Літ.:
Кривобокова С.С. Биологическое окисление: Ист. очерк М., 1971;
Ленинджер А. Основы биохимии:
Строев Е.А. Биологическая химия. М., 1986;
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. 2 изд. М., 1990.
М.М.Філімонаў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
БІЯСФЕ́РА (ад бія... + сфера),
абалонка Зямлі, састаў, структура і энергетыка якой абумоўлены сукупнай дзейнасцю і ўплывамі жывых арганізмаў. Першыя ўяўленні пра біясферу сфармуляваў
Літ.:
Вернадский В.И. Химическое строение биосферы Земли и ее окружения. 2 изд. М., 1987;
Никитин Д.П., Новиков Ю.В. Окружающая среда и человек 2 изд. М., 1986;
Сытник К.М., Брайон А.В., Гордецкий А.В. Биосфера, экология, охрана природы: Справ. пособие. Киев, 1987.
Г.А.Семянюк.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГАЛЫ́Н,
комплексныя злучэнні, крышталегідраты двайных сульфатаў саставу M1MIII(SO4)2∙12H2O ці MI2SO4 × M2III(SO4)3∙24H2O (MI — адназарадны катыён: Na+, K+, Rb+, Cs+, NH4+ і
Вядома некалькі дзесяткаў галынаў. Пры звычайных умовах устойлівыя
У прыродзе трапляецца алюмакаліевы, алюманатрыевы (мінерал чэрмігіт). Выкарыстоўваюць у
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГАРМАНА́ЛЬНЫЯ ПРЭПАРА́ТЫ,
Гарманальныя прэпараты гіпаталамуса і гіпофіза — кортыкатрапін, які стымулюе дзейнасць кары наднырачнікаў, самататрапін — рост арганізма, тыратрапін — сакрэцыю гармонаў шчытападобнай залозы, саматастацін прыгнечвае выпрацоўку гармону росту, лактын павялічвае выдзяленне малака малочнымі залозамі пасля родаў, ганадатрапін стымулюе функцыю палавых залоз, аксітацын, пітуітрын — мускулатуру маткі, вазапрэсін — гладкую мускулатуру. Гарманальныя прэпараты шчытападобнай і парашчытападобнай залозы (тырэаідзін, тыратаксін, паратырэаідзін) назначаюць пры недастатковай функцыі гэтых залоз; кальцытацын рэгулюе абмен кальцыю. Гарманальныя прэпараты падстраўнікавай залозы — інсулін ужываюць пры
А.С.Захарэўскі.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГА́ФНІЙ (
Hf, хімічны элемент IV групы перыядычнай сістэмы,
Бліскучы серабрыста-шэры пластычны метал, існуе ў 2
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГЕРМА́НІЙ (
Ge, хімічны элемент IV групы перыядычнай сістэмы,
Цвёрдае крохкае рэчыва серабрыстага колеру з
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГРАНА́Т (Punica),
род кветкавых раслін
Лістападныя галінастыя кусты або невял. дрэвы
Г.У.Вынаеў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)