ферміён
[ад
элементарная часціца (электрон,
Слоўнік іншамоўных слоў (А. Булыка, 1999, правапіс да 2008 г.)
ферміён
[ад
элементарная часціца (электрон,
Слоўнік іншамоўных слоў (А. Булыка, 1999, правапіс да 2008 г.)
ІВАНЕ́НКА (Дзмітрый Дзмітрыевіч) (29.7.1904,
расійскі фізік-тэарэтык, заснавальнік
Тв.:
Групповые, геометрические и топологические методы в теории поля. Ч. 1.
Калибровочная теория гравитации.
Літ.:
Памяти профессора Д.Д.Иваненко // Вестн. Московского ун-та Сер. 3. Физика. Астрономия. 1995. Т. 36, № 2.
М.М.Касцюкоеіч.

Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ПАЗІТРО́НІЙ,
звязаная сістэма часціц электрона і пазітрона. Падобны на атам вадароду, дзе
Утвараецца пры сутыкненнях павольных пазітронаў з атамамі рэчыва. У залежнасці ад узаемнай арыентацыі спінаў электрона і пазітрона адрозніваюць
Палярызаваны П., утвораны пазітронам, атрыманым пры бэта-распадзе, мае своеасаблівыя ўласцівасці: вектар яго спіна прэцэсіруе вакол напрамку
І.С.Сацункевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ІЗАТАПІ́ЧНАЯ ІНВАРЫЯ́НТНАСЦЬ квантавая сіметрыя, звязаная з аднолькавымі паводзінамі пэўных груп элементарных часціц у моцным ці электраслабым узаемадзеяннях. Адрозніваюць моцную і слабую І.і., якія сваімі ўласцівасцямі нагадваюць сіметрыю адносна паваротаў у 3-мернай прасторы.
І.С.Сацункевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ВАДА́,
аксід вадароду, найпрасцейшае ўстойлівае злучэнне вадароду з кіслародам, H2O. Існуе 9 ізатопных разнавіднасцей, асноўныя з іх 1H216O, колькасць яе ў прэснай вадзе 99,73 малярных % (
Вада слабы электраліт, дысацыіруе на
Прыродная вада мае прымесі (
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
НЕЙТРО́Н (
электранейтральная элементарная часціца са спінам 1/2 і масай, блізкай да масы пратона. Эксперыментальна адкрыты Дж.Чэдвікам у 1932. Адкрыццё Н. дало штуршок для развіцця фізікі атамнага ядра, фізікі дзялення атамных ядраў, нейтроннай фізікі, фізікі нейтронных зорак і інш.
Адносіцца да класа адронаў і ўваходзіць у групу барыёнаў; мае
У.Р.Барышэўскі.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ВАДАРО́Д,
гідраген (
Малекула вадароду двухатамная. Пры звычайных умовах узаемадзейнічае толькі з фторам і хлорам (на святле), пры павышаных т-рах у прысутнасці каталізатараў — з кіслародам (
Газападобны вадарод выкарыстоўваюць для сінтэзу аміяку, хлорыстага вадароду, метылавага і вышэйшых спіртоў, вуглевадародаў, для гідрагенізацыі тлушчу, таксама для зваркі і рэзкі металаў вадародна-кіслародным полымем, вадкі — як гаручае ў ракетнай і
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
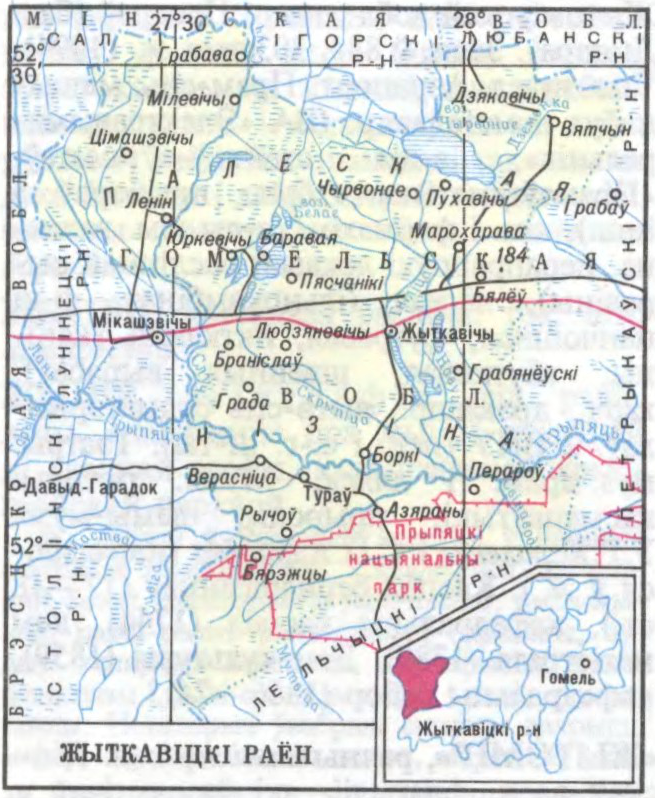
ЖЫ́ТКАВІЦКІ РАЁН,
на
Тэр. раёна ў межах Прыпяцкага Палесся. Паверхня нізінная, плоская, забалочаная, мае нахіл з
Агульная плошча
Вырошчваюць збожжа і бульбу. Прадпрыемствы лясной (лясгас, Тураўскі леспрамгас), тарфяной (Жыткавіцкі торфабрыкетны завод),
С.І.Сідор.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)