ВІНАГРА́Д (Vitis),
род раслін
Шматгадовыя дрэвавыя ліяны з доўгімі (3—5
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ВІНАГРА́Д (Vitis),
род раслін
Шматгадовыя дрэвавыя ліяны з доўгімі (3—5
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГА́ЛІЙ (
Ga, хімічны элемент III
Светла-шэры легкаплаўкі (tпл 29,76 °C) метал з
Выкарыстоўваюць у вытв-сці паўправадніковых матэрыялаў, для «халоднай пайкі» керамічных і металічных дэталей у радыёэлектроніцы, люстраў з высокай адбівальнай здольнасцю, высокатэмпературных (900—1600 °C) тэрмометраў, манометраў.
І.В.Боднар.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
БОР (
B, хімічны элемент III
Вядома больш за 10 алатропных мадыфікацый бора. Бывае бясколерным, шэрым ці чырвоным крышталічным або цёмным аморфным рэчывам і мае розныя
Л.М.Скрыпнічэнка.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
МЫШ’Я́К (
Вядома некалькі алатропных мадыфікацый М.;
Літ.:
Популярная библиотека химических элементов. 3 изд.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ІЗАЛЯ́ЦЫЯ (ад
Літ.:
Дарвин Ч. Происхождение видов путем естественного отбора //
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ЛЕ́ЛЬЧЫЦЫ,
гарадскі пасёлак, цэнтр Лельчыцкага р-на Гомельскай
Вядомы з 16
Прадпрыемствы
В.М.Князева.

Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
КАТЭ́ГОРЫІ (ад
найбольш агульныя і фундаментальныя паняцці, якія адлюстроўваюць самыя істотныя і заканамерныя сувязі, адносіны рэчаіснасці і працэсу пазнання ў філасофіі і навуцы. Існуюць К. агульнанавук. (інфармацыя, сіметрыя), прыродазнаўчыя (
Літ.:
Категории диалектики как ступени познания.
Сагатовский В.Н. Основы систематизации всеобщих категорий. Томск, 1973;
Тузов Н.В. Философия теории Единой идеи.
Эрш Ж. Філасофскае здумленне: Гісторыя заходняе філасофіі:
В.А.Салееў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
«КУЛЬТУ́РНАЯ РЭВАЛЮ́ЦЫЯ»
«
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
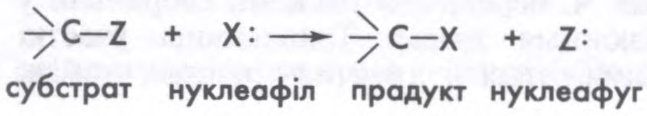
НУКЛЕАФІ́ЛЬНЫЯ РЭА́КЦЫІ,
гетэралітычныя рэакцыі
Пры рэакцыі нуклеафільнага замяшчэння ў насычанага атама вугляроду нуклеафіл (X:) аддае субстрату сваю пару электронаў на ўтварэнне сувязі C—X і пры гэтым выцясняе групу Z:, ці нуклеафуг (ад
Я.Г.Міляшкевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ПАВЕ́РХНЕВА-АКТЫ́ЎНЫЯ РЭ́ЧЫВЫ,
рэчывы, адсорбцыя якіх на паверхні падзелу фаз значна зніжае паверхневае нацяжэнне. П.-а.р. з’яўляюцца
Паводле стану ў растворы П.-а.р. падзяляюць на сапраўды растваральныя (малекулярна-дыспергаваныя) і калоідныя (мылы, алкілфасфаты, аліфатычныя аміны, алкілсульфаты), якія акрамя паверхневай актыўнасці (
Літ.:
Абрамзон А.А. Поверхностноактивные вещества: Свойства и применение. 2 изд.
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб., 1992.
Х.М.Александровіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)