МА́КСВЕЛА ЎРАЎНЕ́ННІ,
асноўныя ўраўненні класічнай макраскапічнай электрадынамікі, што апісваюць
М.ў. звязваюць напружанасць
А.І.Болсун.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
МА́КСВЕЛА ЎРАЎНЕ́ННІ,
асноўныя ўраўненні класічнай макраскапічнай электрадынамікі, што апісваюць
М.ў. звязваюць напружанасць
А.І.Болсун.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
МЕТР (
1) адзінка даўжыні, адна з 7
2) Мера даўжыні, што ўзнаўляе адзінку даўжыні — М. Паводле вызначэння, прынятага 17-й
Першапачаткова (1791, Францыя) М. вызначаны як 1/10 000 000 частка 1/4 даўжыні зямнога мерыдыяна. Для дакладнага вызначэння М. ў 1792—99 праведзены
А.І.Балсун.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
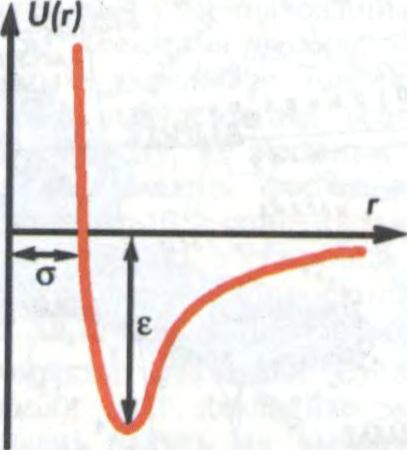
МІЖМАЛЕКУЛЯ́РНАЕ ЎЗАЕМАДЗЕ́ЯННЕ,
узаемадзеянне паміж малекуламі з насычанымі
Характар М.ў. залежыць ад адлегласці паміж малекуламі (r). Пры вялікіх r (r≫l, дзе l — лінейныя памеры малекул, што ўзаемадзейнічаюць) электронныя абалонкі малекул не перакрываюцца, паміж малекуламі пераважаюць сілы прыцягнення (далёкадзейныя сілы), якія маюць
Літ.:
Межмолекулярные взаимодействия: От двухатомных молекул до биополимеров:
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ЛА́ЗЕР (
аптычны квантавы генератар
Л. мае актыўнае асяроддзе, прылады напампоўкі для ўзбуджэння рэчыва ва ўзмацняльны стан і адваротнай сувязі, якая забяспечвае шматразовае праходжанне выпрамянення праз актыўнае рэчыва. Адваротная сувязь ствараецца люстэркамі (
На Беларусі даследаванні і распрацоўкі
Літ.:
Степанов Б.И. Лазеры на красителях.
Яго ж. Лазеры сегодня и завтра.
Качмарек Ф. Введение в физику лазеров:
Тарасов Л.В. Лазеры действительности и надежды.
Войтович А.П., Севериков В.Н. Лазеры с анизотропными резонаторами.
П.А.Апанасевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ДАПАЎНЯ́ЛЬНАСЦІ ПРЫ́НЦЫП,
метадалагічны прынцып, прапанаваны Н.Борам (1927) у сувязі з неабходнасцю стварэння лагічна несупярэчлівай
Мікраскапічныя аб’екты (электроны, фатоны і
Літ.:
Крымский С.Б., Кузнецов В.И. Мировоззренческие категории в современном естествознании. Киев, 1983;
Дополнительность и методология научного познания // Нильс Бор и наука XX в.: Сб. науч.
Мировоззренческие структуры в научном познании.
Л.М.Тамільчык, А.В.Ягораў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
А́ТАМ (ад
часціца рэчыва, найменшая частка
Літ.:
Шпольский Э.В. Атомная физика. Т. 1—2. М., 1984;
Борн М. Атомная физика. М., 1970;
Гольдин Л.Л., Новикова Г.И. Введение в квантовую физику. М., 1988;
Ландау Л.Д., Лифшиц Е.М. Теоретическая физика. Т. 3. Квантовая механика;
Нерелятивистская теория. 4 изд. М., 1989.
М.А.Ельяшэвіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
НЕАРГАНІ́ЧНАЯ ХІ́МІЯ,
навука пра
Гісторыя Н.х. пачынаецца з глыбокай старажытнасці; першыя звесткі пра золата, серабро, медзь, волава і
На Беларусі даследаванні па Н.х. вядуцца ў Ін-це агульнай і неарган. хіміі
Літ.:
Джуа М. История химии:
Штрубе
У.С.Камароў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГАРАЧАТРЫВА́ЛЫЯ МАТЭРЫЯ́ЛЫ,
матэрыялы, якія не дэфармуюцца і не разбураюцца пры высокіх т-рах пад уздзеяннем
Гарачатрывалая сталь мае акрамя жалеза хром, нікель, марганец і
На Беларусі гарачатрывалыя матэрыялы даследуюцца ў
Г.Г.Паніч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГЕАГРА́ФІЯ РАСЛІ́Н,
фітагеаграфія, раздзел батанічнай і
Развіццё геаграфіі раслін як навукі пачалося з даследаванняў
На
Літ.:
Козловская Н.В. Флора Белоруссии, закономерности ее формирования, научные основы использования и охраны.
Парфенов В.И, Ким Г.А., Рыковский Г.Ф. Антропогенныя изменения флоры и растительности Белоруссии.
Г.У.Вынаеў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ЗАКО́Н,
унутраная істотная і ўстойлівая сувязь з’яў, якая абумоўлівае іх развіццё і ўпарадкаванае змяненне. Паняцце З. блізкае да паняцця заканамернасці як сукупнасці ўзаемазвязаных па змесце законаў, якія забяспечваюць устойлівую тэндэнцыю або накіраванасць ў змяненні сістэмы. З. выяўляе і адзін з бакоў сутнасці (
С.Ф.Дубянецкі.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)