ГЛІКО́ЛІ,
дыолы, двухатамныя
Найпрасцейшы гліколі — этыленгліколь і
Я.Г.Міляшкевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ГЛІКО́ЛІ,
дыолы, двухатамныя
Найпрасцейшы гліколі — этыленгліколь і
Я.Г.Міляшкевіч.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ПА́ЛІВА,
рэчывы, якія пры спальванні вылучаюць значную колькасць цеплаты і выкарыстоўваюцца для атрымання цеплавой энергіі. Паводле паходжання падзяляюць на прыроднае (антрацыт, буры вугаль, газы прыродныя гаручыя, гаручыя сланцы, драўніна, каменны вугаль, нафта, торф) і штучнае (
Уласцівасці П. ў значнай ступені абумоўлены яго
Л.М.Скрыпнічэнка.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
ВАДА́,
аксід вадароду, найпрасцейшае ўстойлівае злучэнне вадароду з кіслародам, H2O. Існуе 9 ізатопных разнавіднасцей, асноўныя з іх 1H216O, колькасць яе ў прэснай вадзе 99,73 малярных % (
Вада слабы электраліт, дысацыіруе на пратон H+, які ўтварае ў растворы іон гідраксонію і гідраксільную групу (OH−),
Прыродная вада мае прымесі (
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
втори́чный
1. (повторный) паўто́рны; другаразо́вы; (второй) другі́;
втори́чное собра́ние паўто́рны (другаразо́вы) сход;
втори́чное сообще́ние другаразо́вае паведамле́нне;
втори́чная электри́ческая обмо́тка другаразо́вая электры́чная абмо́тка;
втори́чный прие́зд паўто́рны (другі́) прые́зд;
2. (производный, зависимый) дру́гасны;
втори́чный ток
втори́чные спирты́
втори́чные явле́ния
втори́чный дохо́д
3. (второстепенный) другара́дны; (побочный) пабо́чны;
втори́чные при́знаки другара́дныя адзна́кі.
Руска-беларускі слоўнік НАН Беларусі, 10-е выданне (2012, актуальны правапіс)
НУКЛЕАФІ́ЛЬНЫЯ РЭА́КЦЫІ,
гетэралітычныя рэакцыі
Пры рэакцыі нуклеафільнага замяшчэння ў насычанага атама вугляроду нуклеафіл (X:) аддае субстрату сваю пару электронаў на ўтварэнне сувязі C—X і пры гэтым выцясняе групу Z:, ці нуклеафуг (ад
Я.Г.Міляшкевіч.
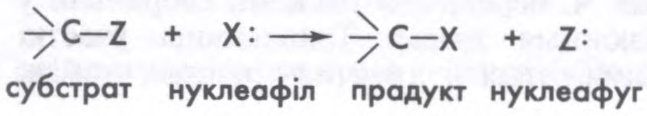
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
НАФТАХІМІ́ЧНАЯ ПРАМЫСЛО́ВАСЦЬ,
галіна прам-сці па вытв-сці
Да 1-й
На Беларусі Н.п. пачала развівацца ў пасляваен.
Я.І.Шчарбіна.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)
БРАДЖЭ́ННЕ,
анаэробны ферментатыўны акісляльна-аднаўляльны працэс расшчаплення (катабалізму)
Спіртавое браджэнне адкрыў
Літ.:
Ленинджер А. Основы биохимии:
Кретович В.Л. Биохимия растений. 2 изд. М., 1986.
А.М.Ведзянееў.
Беларуская Энцыклапедыя (1996—2004, правапіс да 2008 г., часткова)